核准日期:2014 年04月02日
修改日期:2014 年05月27日、2015 年01月26日、2015 年12月01日
修改日期:2020 年10月26日、2020 年12月16日、2021 年11月09日
中国发明专利 专利号:ZL2012 1 0019237.5
注射用兰索拉唑说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:注射用兰索拉唑
英文名称:Lansoprazole for Injection
汉语拼音:Zhusheyong Lansuolazuo
【成份】
本品主要成份为兰索拉唑。
化学名称:2-[[[3-甲基-4-(2,2,2-三氟乙氧基)-2-吡啶基]甲基]亚硫酰基]-1H-苯并咪唑。
化学结构式:
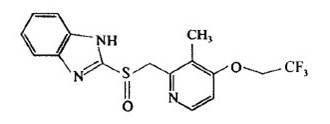
分子式:C16H14F3N3O2S
分子量:369.37
辅 料:葡甲胺、甘露醇、氢氧化钠
【性状】 本品为白色或类白色疏松块状物或粉末。
【适应症】 用于口服疗法不适用的伴有出血的胃、十二指肠溃疡、急性应激溃疡、急性胃粘膜损伤。
【规格】 30mg
【用法用量】
静脉滴注。通常成年人每次30mg,一日2次,疗程不超过7天。一旦患者可以口服药物,应改换为兰索拉唑口服剂型。
临用前用100ml 0.9%氯化钠注射液或5%葡萄糖注射液溶解,静脉滴注,推荐给药时间不少于30分钟。
使用时注意:
(1)本品在给药后3日之内即可取得良好的止血效果,患者能够口服用药后应改为口服,不可无限制静脉给药。临床试验中,本品目前尚无超过7天的用药经验。
(2)在喷出性或涌出性大量出血、血管暴露等危险性大的情况下,应先采用内窥镜下止血措施。
(3)溶解后应尽快使用,勿保存。由于可能出现变色和沉淀,因此,避免与0.9% 氯化钠注射液或5%葡萄糖注射液以外的液体和其他药物混合静滴。
(4)使用本品时应使用专用的输液器,不得与其他药物共用。万不得已需要通过其他药物的输液器侧管给予本品时,应停止输注其他药物,并在本品给药之前和之后用0.9%氯化钠注射液或5%葡萄糖注射液冲管。
(5)本品静滴使用时应配有孔径为1.2μm的过滤器,以便去除输液过程中可能产生的沉淀物。这些沉淀物有可能引起小血管栓塞而产生严重后果。
【不良反应】
注射用兰索拉唑的国内临床研究中,观察到的不良反应包括:头痛、头晕、困倦、纳差、腹部不适、腹泻、丙氨酸氨基转移酶(ALT)升高、外周血白细胞(WBC)下降、肾功能异常、输液局部轻度刺激反应、过敏、皮疹。
美国4个临床试验中有161名患者使用注射用兰索拉唑,超过1% 的不良反应有恶心(1.3%)、头痛(1%)、注射部位痛感(1%);低于1% 的不良反应有腹痛、腹泻、消化不良、呕吐、头晕、感觉异常、味觉异常、皮疹和血管扩张。未见与口服给药不同的不良反应。
日本221例受试者使用注射用兰索拉唑的临床研究资料报告,发生31例(14.0%)临床实验室检查值异常,主要为ALT升高(6.2%)、天门冬氨酸氨基转移酶(AST)升高(5.7%)、乳酸脱氢酶(LDH)升高(2.0%)、γ-谷氨酰转移酶(γ-GGT)升高(1.5%)等。
日本注射用兰索拉唑上市后监测中,1142例患者中有35例(3.1%)出现包括实验室检查异常在内的不良反应。主要不良反应为腹泻、肝功能异常、肝损伤、发热和白细胞减少(各0.3%)。
1.治疗时应密切观察,如有下列严重的不良反应,应及时停药和处理。
(1)速发过敏反应(全身皮疹、面部水肿、呼吸困难等),休克。
(2)全血细胞减少、粒细胞缺乏症、溶血性贫血、粒细胞减少、血小板减少、贫血。
(3)伴有黄疸、AST和ALT升高等重度肝功能障碍。
(4)中毒性表皮坏死松解症、皮肤粘膜眼综合征(Stevens-Johnson综合征)。
(5)间质性肺炎:出现发热、咳嗽、呼吸困难、肺部呼吸音异常(捻发音)等时,应迅速停药,实施胸部X线检查,并给予肾上腺皮质激素等适当的处理。
(6)间质性肾炎:由于可能导致急性肾损伤,应注意监测肾功能(血尿素氮,血肌酐等)。
(7)视觉损害。
2.其他的不良反应:
发生率
不良反应 |
5%以上 |
0.1%~<5% |
<0.1% |
频率不明 |
1) 超敏反应 |
|
皮疹注2) |
|
瘙痒、多形性红斑 |
2)皮肤 |
|
|
|
亚急性皮肤型红斑狼疮 |
3) 肝脏注2) |
AST、ALT升高 |
碱性磷酸酶(AlP)、LDH、γ-GGT升高 |
|
|
4) 血液系统 |
|
嗜酸性粒细胞增多 |
|
|
5) 消化系统 |
|
腹泻 |
便秘注2)、味觉异常注2) |
口渴、腹胀、恶心、呕吐、食欲不振、腹痛、念珠菌病、口腔黏膜炎、舌炎、结肠炎(包括胶原性结肠炎等注1)) |
6) 精神神经系统 |
|
失眠注2)、震颤 |
抑郁状态注2)、 |
头痛、嗜睡、眩晕 |
7) 其他 |
|
发热、尿酸升高 |
无力注2) |
男性乳腺发育注1)、水肿、不适、舌、口唇麻木感、四肢麻木感、肌肉痛、脱发、视物模糊、关节痛、低钠血症,低镁血症,总胆固醇升高 |
注1)如果持续腹泻,可能提示有胶原性结肠炎,应立即停药。因可能导致肠粘膜溃疡、糜烂、易出血,如出现出血、便血情况,应采取适当的处理措施。
注2)发生频率基于上市后监测结果。
【禁忌】
1.对本品中任何成份过敏的患者禁止使用本品。
2.正在使用硫酸阿扎那韦、盐酸利匹韦林的患者禁止使用本品。
【注意事项】
1. 以下患者慎重用药:(1)有药物过敏症既往史的患者;(2)肝功能障碍的患者(因本药的代谢、排泄延迟)。
2. 本品治疗可能会掩盖胃癌的症状,应排除恶性肿瘤后方可用药。
3. 本品治疗时密切观察病情,治疗无效时应改用其它疗法。
4. 国外多项观察性研究报告,在质子泵抑制剂治疗患者中,骨质疏松症相关髋部骨折,腕骨骨折和脊柱骨折风险增加。接受高剂量和长期(超过1年)质子泵抑制剂治疗患者的骨折风险增加尤其明显。
5. 国外住院患者观察性研究报告,在质子泵抑制剂治疗患者中,难辨梭状芽胞杆菌引起胃肠道感染的风险增加。
6. 动物实验中,大鼠长期大量使用本品后,出现良性睾丸间质细胞肿瘤、类癌瘤与视网膜萎缩。但类似现象在小鼠的致癌性试验、犬、猴的毒性试验中未出现。
【孕妇及哺乳期妇女用药】
大鼠口服兰索拉唑的试验中可见胎仔血浆中兰索拉唑药物浓度比母体血浆中药物浓度高;另外,兔(口服30mg/kg/日)试验中可见胎仔死亡率的增加。对孕妇和可能妊娠的妇女,建议只有在判断治疗的益处大于风险时方可使用本品。
大鼠口服兰索拉唑的试验中,兰索拉唑可经母乳分泌。建议哺乳期妇女尽量避免使用本品,必须用药时,应停止哺乳。
【儿童用药】儿童使用本品的安全性尚未确定,尚无使用经验。
【老年用药】 一般老年人生理机能下降,故应慎重用药。
【药物相互作用】 兰索拉唑主要通过肝药物代谢酶CYP2C19或CYP3A4代谢。 此外,兰索拉唑的胃酸分泌抑制作用可促进或抑制一些合用药物的吸收。
1. 配伍禁忌
药品名称 |
临床表现 |
作用机理、危险因素 |
硫酸阿扎那韦 |
有可能减弱硫酸阿扎那韦的药效。 |
本品的胃酸分泌抑制作用能够降低阿扎那韦的溶解度,使血药浓度下降。 |
盐酸利匹韦林 |
有可能减弱盐酸利匹韦林的药效。 |
本品的胃酸分泌抑制作用能够降低盐酸利匹韦林的吸收,使血药浓度下降。 |
2. 配伍注意
药品名称 |
临床表现 |
作用机理、危险因素 |
茶碱 |
茶碱的血药浓度下降。 |
本品诱导肝脏药物代谢酶,可促进茶碱的代谢。 |
他克莫司 |
他克莫司的血药浓度升高。 |
本品可竞争性阻断肝脏药物代谢酶对他克莫司的代谢。 |
地高辛、
甲基地高辛 |
有增强药物作用的可能性。 |
由于本品的胃酸分泌抑制作用,抑制地高辛水解,有使其血药浓度升高的可能性。 |
伊曲康唑、吉非替尼、博舒替尼 |
有减弱药物作用的可能性。
尽量避免与博舒替尼一起使用。 |
由于本品的胃酸分泌抑制作用,存在使药物的血药浓度下降的可能性。 |
甲氨蝶呤 |
甲氨蝶呤的血药浓度可能升高。使用大剂量甲氨蝶呤时,应考虑暂时停用本品。 |
机制不明 |
苯妥英、
地西泮 |
有增强药物作用的可能性。 |
有报告同类药物奥美拉唑可延缓药物的代谢、排泄。 |
【药物过量】目前无药物过量的临床经验供参考,但兰索拉唑不能通过血液透析从循环系统中清除。
【药理毒理】
药理作用
兰索拉唑属于质子泵抑制剂。本药分布于胃粘膜壁细胞的酸性环境后,转变为有活性的代谢物。这种代谢物与存在于酸生成部位的H+,K+-ATP酶的巯基结合,通过抑制H+,K+-ATP酶的活性而抑制胃酸分泌。
兰索拉唑抑制胃酸分泌作用呈剂量依赖性,药后24小时内对基础和刺激引起的胃酸分泌均有抑制作用。健康成人1次30mg,一日2次静脉给药,可见持续的胃酸分泌抑制作用。
有报道在酸性条件下,血液凝固与血小板聚集受到很大损害。血液凝固所形成的纤维蛋白,在酸性条件下可被胃蛋白酶溶解。本药通过升高胃内pH值而改善血液凝固与血小板聚集功能,抑制胃蛋白酶的活性而发挥抑制出血的作用。另外,在酸性条件下,胃的损伤粘膜的修复受到抑制,本药通过抑制酸分泌而使胃内pH值上升,促进损伤粘膜的修复。
毒理研究
遗传毒性
Ames试验、大鼠肝细胞程序外DNA合成试验以及小鼠微核试验、大鼠骨髓细胞染色体畸变试验结果均为阴性。体外人淋巴细胞染色体畸变试验结果为阳性。
生殖毒性
大鼠和家兔静脉给予兰索拉唑剂量达30mg/kg/天(按体表面积计算相当于人临床推荐剂量的8倍和16倍),未发现对生育力和胚胎有不良影响。
致癌性
SD大鼠连续24个月口服兰索拉唑5-150 mg/kg/天(按体表面积计算相当于体重为50公斤患者的临床推荐剂量30 mg/天的1~40倍),结果显示兰索拉唑以剂量依赖方式诱发胃肠嗜铬样(ECL)细胞增生和良性ECL细胞瘤,受试动物胃上皮出现肠上皮化的发生率增加。雄性大鼠睾丸间质细胞腺瘤发生率以剂量相关方式增加,给药剂量为15~150 mg/kg/天(按体表面积计算相当于人临床推荐剂量的4~40倍)的大鼠,这些腺瘤的发生率超过该种系大鼠的自然发生率(1.4~10%)。在一年的毒性研究中,给药剂量为50 mg/kg/天(按体表面积计算相当于人临床推荐剂量13倍)的30只大鼠中,有1只出现睾丸间质细胞腺瘤。
CD-1小鼠连续24个月口服兰索拉唑15~600 mg/kg/天(按体表面积计算相当于人临床推荐剂量的2~80倍),结果兰索拉唑以剂量依赖方式诱发ECL细胞增生,给药小鼠肝脏肿瘤发生率升高,300和600 mg/kg/天组雄性小鼠和150~600 mg/kg/天组雌性小鼠肿瘤的发生率超过了该种系小鼠历史肿瘤的发生率范围。给予兰索拉唑75~600 mg/kg/天,小鼠发生睾丸腺瘤。
【药代动力学】
吸收 兰索拉唑静脉给药时,血清中浓度存在个体差异。
12例健康成年男子,依据CYP2C19基因型分为快代谢者组与慢代谢者组,1次30mg,一日2次,静脉点滴5日,主要药动学参数如表所示。
参数 |
CYP2C19代谢型 |
AUC0-12(ng·h/mL) |
Cmax(ng/mL) |
t1/2(h) |
1天 |
快代谢组 |
4386±1335 |
2262±354 |
1.5±0.4 |
慢代谢组 |
10415±1159 |
2727±315 |
4.0±0.7 |
5天 |
快代谢组 |
4939±1541 |
2414±406 |
1.6±0.5 |
慢代谢组 |
12579±1939 |
3134±316 |
4.2±1.1 |
分布 兰索拉唑在 0.05-5μg/ml浓度范围内的人血清蛋白结合率约为98%(体外试验)。
代谢 兰索拉唑主要通过CYP2C19酶和CYP3A4酶代谢(体外试验)。
排泄 健康成年男子(9例)单次静脉给药30mg,尿中未见原形药,全部为代谢产物,至给药结束24小时后的尿中累积排泄率为12%~17%。
【贮藏】 遮光、密闭,不超过30℃保存。
【包装】 中硼硅玻璃管制注射剂瓶、冷冻干燥注射用局部覆聚四氟乙烯膜卤化丁基橡胶塞(溴化)、抗生素瓶用铝塑组合盖。2瓶/盒,5瓶/盒,10瓶/盒。
【有效期】 18个月
【执行标准】 国家药品监督管理局药品注册标准YBH14582021
【批准文号】 国药准字H20140044
【上市许可持有人】
企业名称:开运体育(中国)官方网站苏州制药厂
注册地址:苏州市吴中区东吴南路2-1号
【生产企业】
企业名称:开运体育(中国)官方网站苏州制药厂
生产地址:苏州市吴中区东吴南路2-1号
邮政编码:215168
电话号码:0512-65256080 65251551
传真号码:0512-66262681
网 址:http://www.give2ipf.com
S-D-2021(9)-19




